データなし
コード銘柄名
現在値変化額変化率出来高売買代金始値前日終値高値安値時価総額浮動株時価株式総数浮動株5日変化率10日変化率20日変化率60日変化率120日変化率250日変化率年初来配当利回売買回転率直近PER前年PER振幅業種
お気に入りデモ取引
データなし
英国の製薬会社はシェア価格に一定の変動があるが、長期的な展望は変わらない -- 市場の話
0836 GMT - 英国の製薬会社はシェア価格に変動がある可能性がありますが、長期的な見通しは、現在薬を免除しているアメリカのトランプ大統領が課したグローバル輸入に対する関税の影響を受けるべきではありません。
バークレイズはGSKをイコールウェイトに維持し、Q1の売上高はコンセンサスと一致すると見込んでいます。
バークレイズはGSK(GSK.L)に対するイコールウェイトの評価を維持し、製薬会社の売上とコアEPSが2025年第1四半期の期待通りであることに注目しました。調査会社は保持しました
帯状疱疹ワクチンは認知症の発症リスクを減少させることができる - 研究
SAが尋ねます:FDAの変更はワクチン製造業者にどのように影響しますか。
【市場の声】英製薬株、英国が低関税を獲得すれば欧州勢を上回る可能性
本日の米国株【200日線|下抜き】 120 銘柄 (04月01日)
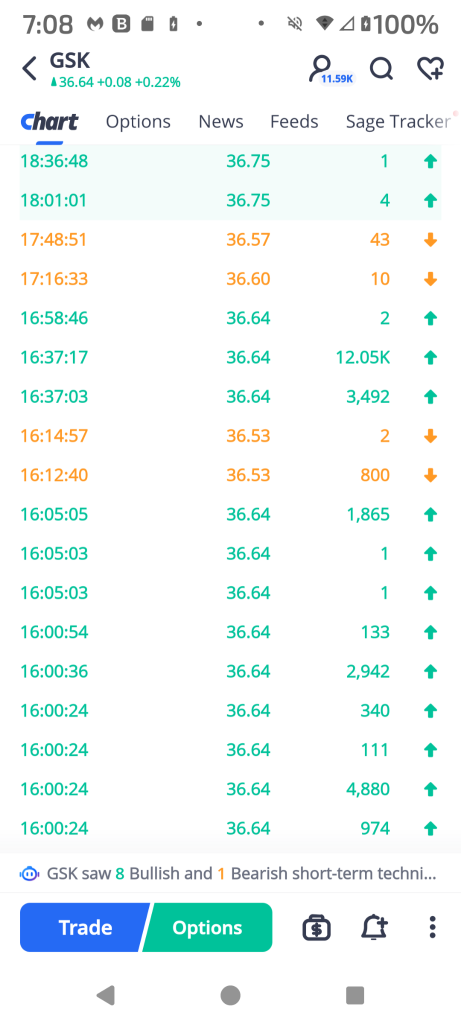
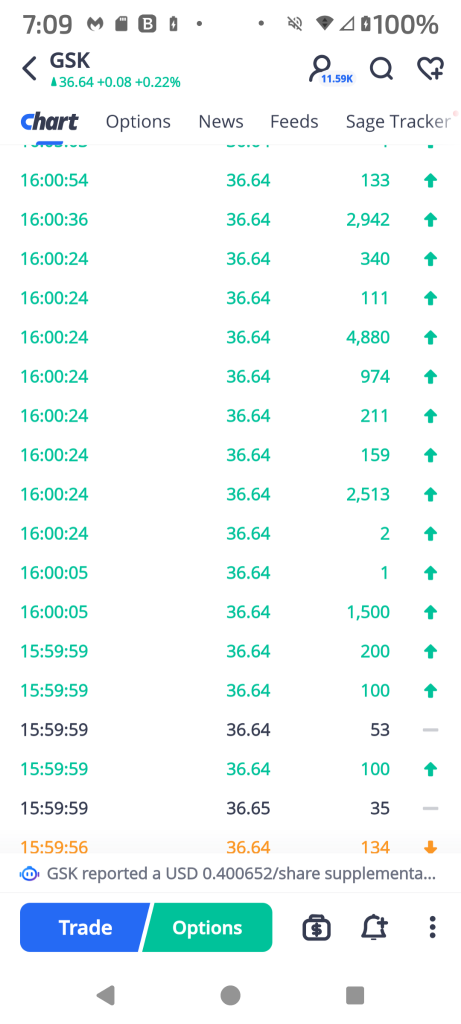
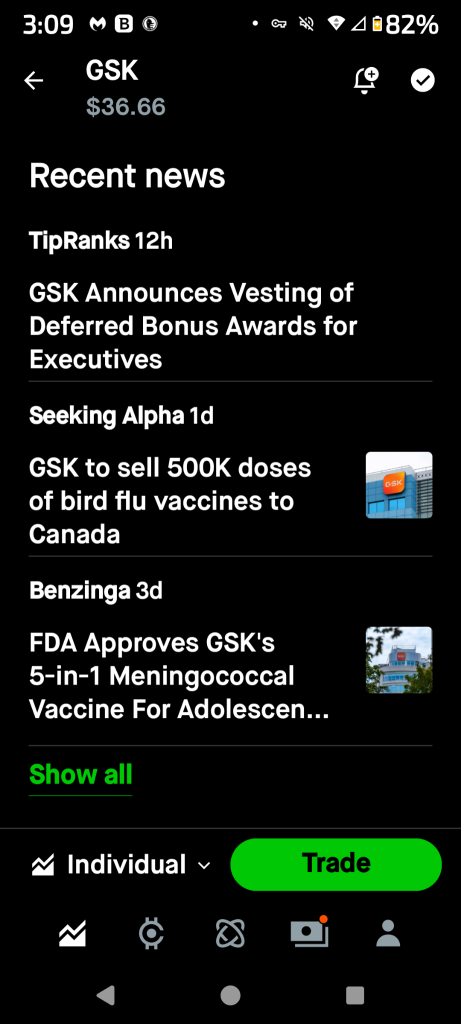
74428470 : そのような事実は株価をプッシュアップすることができない、残念だ